O eletrocardiograma (ECG) é um dos exames mais utilizados na prática clínica — e, paradoxalmente, um dos mais mal interpretados. Parte desse problema não está no método, mas na quantidade de mitos do ECG que foram sendo repetidos ao longo do tempo até ganharem status de verdade.
Supradesnivelamento “feliz”, onda T correpondendo a “isquêmica subepicardica”, progressão lenta da onda R como cicatriz anterior, S1Q3T3 patognomônico de tromboembolismo pulmonar (TEP), parede dorsal, algoritmos infalíveis, voltagem igual a sobrecarga. Esses conceitos parecem facilitar a leitura do traçado, mas na prática simplificam demais fenômenos elétricos complexos — e isso cobra um preço clínico.
Neste artigo, vamos revisar alguns dos principais mitos do ECG, explicando por que eles surgiram, por que não se sustentam à luz da fisiopatologia e da evidência científica atual, e como interpretar esses achados de forma mais madura e segura. A proposta não é decorar novos critérios, mas mudar o jeito de pensar o ECG.
Porque, no fim das contas, o traçado raramente mente. O que costuma falhar é a leitura automática, descontextualizada — e cheia de mitos.
O Supradesnivelamento Feliz
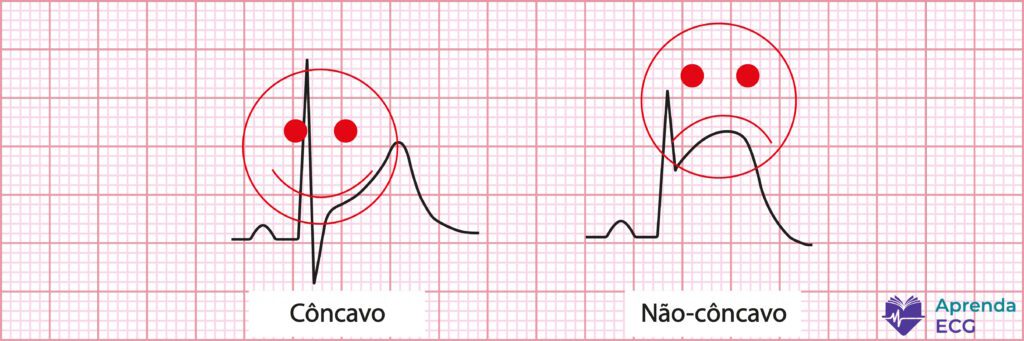
Existe um mito clássico no ECG que atravessa gerações: supradesnivelamento do ST côncavo é benigno, o convexo é isquêmico. Daí nasceu o termo informal — e perigosamente tranquilizador — do “supradesnivelamento feliz”.
A ideia parece simples, quase confortável: se o ST está em formato de sorriso, o coração está bem. Se está em forma de careta, melhor correr. O problema é que o miocárdio não leu esse manual.
Diversos estudos já mostraram que a morfologia do ST, isoladamente, não é capaz de diferenciar com segurança isquemia de causas não isquêmicas. Um trabalho clássico de Smith et al. demonstrou que a morfologia côncava do supradesnivelamento do ST esteve presente em até 43% dos pacientes com oclusão aguda da artéria descendente anterior, desmontando a ideia de que o formato “em sorriso” seria protetor.
Na prática clínica, isso significa algo simples e incômodo: ST côncavo não exclui infarto. E mais — em alguns cenários, ele pode até estar associado a fases mais precoces da oclusão coronária, quando o dano ainda não evoluiu para padrões mais exuberantes.
Outro ponto pouco lembrado é que o formato do ST é dinâmico. Um mesmo paciente pode iniciar com um supradesnivelamento côncavo, evoluir para um ST retificado e, horas depois, apresentar um padrão convexo. Fotografar um único momento do traçado e tirar conclusões definitivas é um erro clássico.
Vale lembrar que esse mito já foi discutido em detalhe aqui no blog, inclusive com exemplos de ECG reais e revisão da literatura. Para quem quiser se aprofundar, vale a leitura: O Mito do Supra Feliz.
Então, se o supra feliz não existe, o que vale?
Vale o contexto clínico. Vale a presença de alterações recíprocas. Vale a comparação com ECGs prévios. Vale a evolução seriada do traçado. O ST não deve ser julgado pelo sorriso — mas pela história que ele conta junto com o paciente.
A Progressão Lenta da Onda R
Outro mito clássico do ECG é a ideia de que a progressão lenta da onda R nas precordiais seja, por definição, um marcador confiável de infarto antigo da parede anterior. Esse conceito é repetido há décadas em livros, laudos automatizados e discussões de beira-leito — muitas vezes sem questionamento.
Tradicionalmente, ensina-se que a onda R deve crescer progressivamente de V1 até V4–V5. Quando isso não acontece, e a onda R permanece pequena ou “atrasada” nas derivações anteriores, surge o rótulo de progressão lenta da onda R. O problema começa quando esse achado isolado passa a ser interpretado automaticamente como cicatriz miocárdica.
A realidade é bem menos elegante.
A progressão lenta da onda R não tem definição única na literatura. Existem múltiplos critérios diagnósticos, alguns extremamente simples (como R ≤ 3 mm em V3), outros tão complexos que mais parecem fórmulas de física aplicada. Essa falta de padronização já seria suficiente para gerar cautela.
Mais importante ainda: a evidência científica que sustenta a associação entre progressão lenta da onda R e infarto antigo é fraca. Estudos clássicos são antigos, metodologicamente limitados e frequentemente enviesados. Quando a literatura é analisada de forma crítica, não há dados robustos que validem esse achado como marcador confiável de necrose anterior.
Na prática, a progressão lenta da onda R é um achado inespecífico e relativamente comum, podendo estar presente em indivíduos sem qualquer doença coronariana. Alterações de condução, sobrecarga ventricular, pré-excitação, posicionamento dos eletrodos e até variantes anatômicas — como a rotação horária do coração — explicam muitos desses traçados.
Ou seja: progressão lenta da onda R não é sinônimo de infarto antigo. Usá-la isoladamente para fechar diagnóstico retrospectivo é um erro conceitual que pode levar a investigações desnecessárias, rótulos equivocados e ansiedade evitável.
Assim como no mito do supra feliz, aqui também vale a regra de ouro do ECG: nenhum achado deve ser interpretado fora de contexto.
Antes de chamar de infarto antigo, pergunte-se: o traçado está contando uma história completa — ou só uma frase fora do contexto?

A Onda T Negativa e a Isquemia Subepicárdica
Poucos termos do ECG são tão repetidos — e tão mal compreendidos — quanto a ideia de que onda T negativa corresponde a isquemia subepicárdica. Esse rótulo ainda aparece em aulas, livros antigos e, infelizmente, em laudos de rotina. O problema é que ele está conceitualmente errado.
Vamos ao ponto central: onda T negativa não indica isquemia aguda.
Na doença isquêmica do coração, a inversão da onda T é, na maioria das vezes, um fenômeno pós-isquêmico, relacionado à reperfusão — espontânea ou induzida — e ao edema miocárdico. É o que vemos após a abertura de uma artéria, após trombólise ou mesmo após episódios transitórios de oclusão. O clássico padrão de Wellens é o melhor exemplo disso: ondas T profundamente negativas, em um paciente que não está mais isquêmico naquele momento, mas que corre alto risco de nova oclusão se nada for feito.
Ou seja: a onda T negativa olha para o passado, não para o presente.
Mas o erro não para aí.
Do ponto de vista fisiopatológico, não existe isquemia restrita ao epicárdio. Quando uma artéria coronária epicárdica se oclui, a isquemia começa inevitavelmente no subendocárdio — região mais vulnerável — e progride rapidamente em direção ao epicárdio, tornando-se transmural. Não há cenário realista em que o miocárdio epicárdico esteja isquêmico enquanto o subendocárdio permanece preservado.
Portanto, o termo “isquemia subepicárdica” não apenas é impreciso: ele descreve algo que fisiologicamente não acontece.
Além disso, a onda T negativa é um achado extremamente inespecífico. Pode ser observada em sobrecarga ventricular, bloqueios de ramo, miocardiopatias, miocardite, pericardite, distúrbios eletrolíticos, alterações neurológicas agudas, memória elétrica pós-taquicardia e até como variante da normalidade. Interpretá-la isoladamente como isquemia ativa é uma receita pronta para erro diagnóstico.
Na prática, isso leva a duas mensagens importantes:
- Onda T negativa não deve ser laudada como isquemia aguda.
- O termo isquemia subepicárdica não deveria ser utilizado em laudos de ECG.
Assim como outros mitos do ECG, este persiste mais por tradição do que por ciência. Interpretar corretamente a onda T exige contexto clínico, análise da despolarização, comparação com traçados prévios e, sobretudo, compreensão da fisiopatologia real da isquemia miocárdica.
No ECG, a onda T negativa não grita “infarto agora”. Na maioria das vezes, ela apenas sussurra: algo já aconteceu aqui antes.

O Aumento da Duração da Onda P
Outro mito profundamente enraizado no ensino do ECG é a ideia de que onda P alargada (≥ 120 ms) seja sinônimo de sobrecarga atrial esquerda (SAE). Esse conceito é repetido de forma quase automática, mas não resiste a uma análise eletrofisiológica mais cuidadosa.
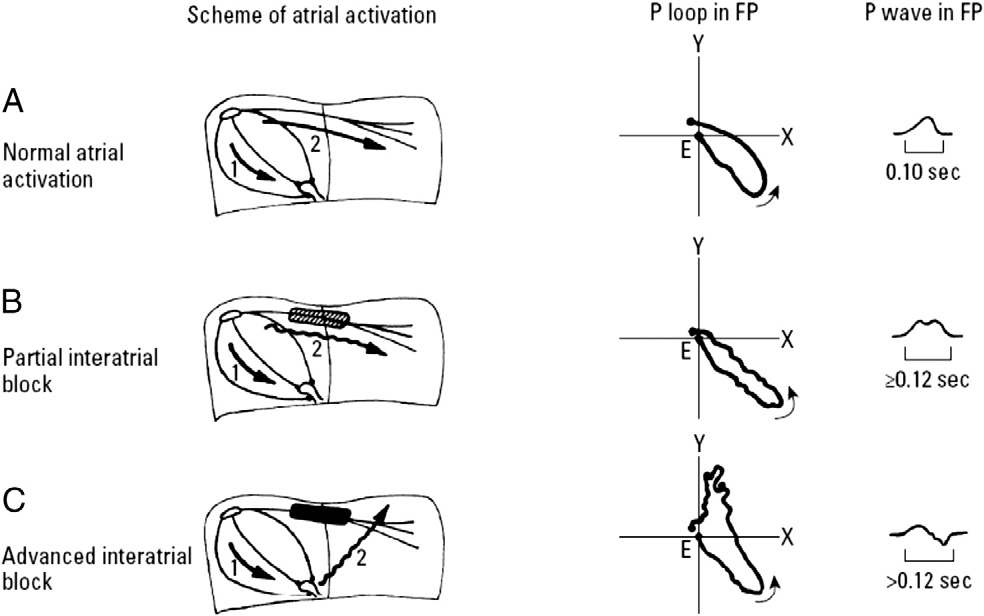
Na realidade, o aumento da duração da onda P é, primariamente, um marcador de atraso de condução interatrial — ou seja, bloqueio interatrial (BIA), e não de aumento de massa ou volume do átrio esquerdo.
A lógica é simples: quando algo fica mais largo no ECG, quase sempre estamos falando de retardo de condução, não de hipertrofia. Assim como QRS largo sugere bloqueio de ramo e não “ventrículo grande”, a onda P prolongada reflete atraso na propagação do estímulo elétrico entre o átrio direito e o átrio esquerdo.
Esse conceito foi elegantemente sistematizado por Bayés de Luna, que demonstrou que os padrões clássicos de onda P longa — isolada ou com morfologia plus-minus nas derivações inferiores — correspondem a diferentes graus de bloqueio interatrial, entidade distinta da sobrecarga atrial esquerda.
O ponto-chave, muitas vezes ignorado, é que o bloqueio interatrial pode existir na ausência de dilatação atrial esquerda, e o inverso também é verdadeiro. Estudos com ecocardiografia e ressonância cardíaca mostraram que a onda P ≥ 120 ms tem baixo valor diagnóstico para SAE isoladamente, mas excelente correlação com distúrbios de condução atrial.
Quando o atraso é mais avançado, com bloqueio funcional da região de Bachmann, o estímulo passa a ativar o átrio esquerdo de forma retrógrada, gerando a clássica onda P com morfologia ± em D2, D3 e aVF — o chamado bloqueio interatrial avançado, base eletrocardiográfica da síndrome de Bayés, associada a maior risco de fibrilação atrial, flutter atrial e eventos tromboembólicos.
Na prática, isso muda tudo.
Laudar uma onda P longa como “sobrecarga atrial esquerda” não apenas é impreciso, como perde a oportunidade de reconhecer um marcador arrítmico relevante. O termo correto descreve o mecanismo real: atraso de condução interatrial.
Vale reforçar que esse tema já foi amplamente discutido aqui no blog, tanto do ponto de vista conceitual quanto clínico:
- Bloqueios interatriais: conceito, classificação e implicações clínicas
- Síndrome de Bayés: o que o clínico precisa saber
Em resumo: onda P larga não fala de tamanho — fala de tempo. E, no ECG, tempo quase sempre significa condução.
O Padrão S1Q3T3
Poucos padrões do ECG carregam um peso simbólico tão grande — e tão desproporcional — quanto o S1Q3T3. Para muitos, ele ainda é visto como um sinal quase patognomônico de TEP. A realidade, porém, é bem diferente.
O padrão S1Q3T3 descreve simplesmente três achados: onda S profunda em D1, onda Q em D3 e onda T negativa em D3. Ele reflete um desvio agudo do eixo elétrico para a direita, geralmente associado à sobrecarga súbita do ventrículo direito. E aqui está o primeiro ponto importante: ele não fala de causa, fala de fisiologia.
Historicamente, o S1Q3T3 foi descrito em 1935 por McGinn e White em pacientes com cor pulmonale agudo. Desde então, o padrão foi incorporado ao imaginário médico como “o ECG do TEP”. O problema é que, quando estudado de forma sistemática, esse vínculo se mostra fraco.
Na prática, o S1Q3T3 é pouco sensível e pouco específico para TEP. Ele aparece em uma minoria dos pacientes com embolia pulmonar e pode estar presente em diversas outras condições que cursam com sobrecarga aguda ou crônica do ventrículo direito, como exacerbação de DPOC, hipertensão pulmonar, pneumotórax, crises asmáticas graves e até em situações não cardiopulmonares.
Mesmo quando presente no contexto de TEP, seu valor diagnóstico é limitado. Estudos modernos de acurácia mostram que o S1Q3T3 produz apenas um pequeno aumento na probabilidade pós-teste, insuficiente para confirmar ou excluir o diagnóstico de forma confiável. Em outras palavras: ele impressiona mais do que ajuda.
O erro conceitual mais comum é inverter o raciocínio: ver um S1Q3T3 e concluir “isso é TEP”. O correto é exatamente o oposto. O ECG nunca fecha diagnóstico de TEP. No máximo, pode sugerir sobrecarga de ventrículo direito em um paciente cuja história clínica já levanta essa hipótese.
Por isso, o S1Q3T3 deve ser entendido como o que ele realmente é: um marcador inespecífico de estresse do ventrículo direito, e não um carimbo diagnóstico de embolia pulmonar.
Esse tema já foi discutido em profundidade aqui no blog, em um dos artigos mais lidos do Aprenda ECG: O Padrão Q1Q3T3.
Se existe um mito a ser abandonado, é este: S1Q3T3 não diagnostica TEP. Ele apenas lembra que o ventrículo direito está sofrendo — e que o próximo passo depende do contexto clínico, não do traçado isolado.
A Parede Dorsal
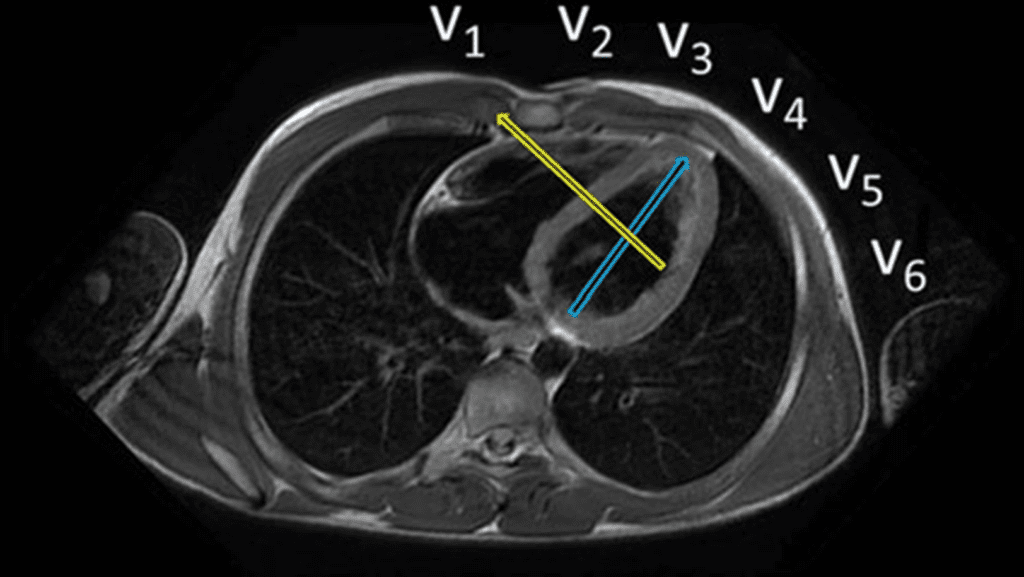
A chamada “parede dorsal” é um dos mitos mais duráveis do ECG. Durante décadas, ensinou-se que certas alterações — especialmente onda R alta em V1–V2 — representariam um infarto da parede posterior (ou dorsal). O problema é que essa parede, do jeito que foi imaginada, praticamente não existe.
O erro nasce de uma premissa anatômica equivocada. O coração não está disposto no tórax como um bloco anterior–posterior. Ele ocupa uma posição oblíqua, e a região antes chamada de “posterior” corresponde, na verdade, ao segmento inferobasal, que faz parte da parede inferior, e não de uma parede independente.
Com o avanço da ressonância magnética cardíaca, esse dogma caiu. Estudos de correlação ECG–RMC mostraram que:
- Onda R aumentada em V1–V2 não indica infarto posterior.
- Esse padrão, quando relacionado a infarto, corresponde mais frequentemente a infarto da parede lateral, cujo vetor de necrose se projeta em direção às derivações direitas.
- Um infarto isolado da suposta “parede posterior” é excepcionalmente raro.
Por isso, a terminologia moderna abandonou o termo “parede posterior/dorsal”. A classificação atual descreve as paredes de forma mais precisa: anterior, septal, lateral e inferior, com seus segmentos basal, médio e apical. O que antes se chamava de “posterior” passou a ser corretamente reconhecido como inferior (inferobasal).
Na prática clínica, insistir no rótulo de parede dorsal gera confusão diagnóstica, interpretações erradas do ECG e comunicação imprecisa entre clínico, hemodinamicista e imagem. Nomear errado é pensar errado.
Se a ideia é localizar o infarto com mais precisão, o caminho não é ressuscitar conceitos antigos, mas entender a anatomia real e os vetores elétricos envolvidos.
Para quem quiser se aprofundar — e realmente organizar esse tema — recomendo fortemente o artigo do blog sobre as paredes do infarto, que integra anatomia, ECG e evidências de imagem:
Resumo do mito: parede dorsal não é uma entidade anatômica válida no ECG moderno. O traçado melhora quando a nomenclatura também melhora.
A Acurácia dos Algoritmos das Taquicardias de QRS Largo
Talvez nenhum tema do ECG gere tanta confiança excessiva quanto os algoritmos para o diagnóstico diferencial das taquicardias de QRS largo. Fluxogramas bem desenhados, passos numerados e números impressionantes de sensibilidade e especificidade criam a sensação de que o problema está resolvido. Não está.
O exemplo clássico é o algoritmo de Brugada. No estudo original, publicado em 1991, o desempenho foi quase perfeito: sensibilidade e especificidade acima de 95%, algo raríssimo em medicina diagnóstica. O problema é que esse desempenho nunca foi reproduzido de forma consistente em coortes externas.
Quando o algoritmo de Brugada passou a ser testado por outros grupos, em populações diferentes e com observadores menos especializados, o cenário mudou. A sensibilidade para taquicardia ventricular (TV) permaneceu relativamente alta, mas a especificidade caiu de forma importante, muitas vezes para valores entre 40% e 60%. Em termos práticos, isso significa um número elevado de falsos positivos para TV.
Esse fenômeno não é exclusivo do Brugada. Estudos comparativos mostram que nenhum algoritmo isolado apresenta acurácia suficientemente alta para resolver o diagnóstico diferencial das taquicardias de QRS largo em todos os cenários. Em validações externas, a acurácia global da maioria dos métodos — Brugada, Vereckei, Bayesiano, Griffith, tempo de pico da onda R em D2 — costuma ficar na faixa de 70% a 77%.
Existem razões claras para isso.
Primeiro, muitos critérios dependem de interpretação subjetiva, especialmente os critérios morfológicos. O que exatamente é um complexo RS? Onde termina a onda R e começa a S? O entalhe é real ou artefato? Pequenas diferenças de interpretação mudam completamente o resultado do algoritmo.
Segundo, os algoritmos foram desenvolvidos principalmente para diferenciar TV de TSV com aberrância, mas falham com frequência nas taquicardias supraventriculares pré-excitadas, que ativam o ventrículo por condução miocárdica e mimetizam perfeitamente uma TV no ECG.
Terceiro, a performance dos algoritmos é altamente dependente da experiência do observador e do contexto clínico. TVs idiopáticas, TVs fasciculares, pacientes com bloqueios prévios ou cicatrizes miocárdicas reduzem ainda mais a confiabilidade dos critérios clássicos.
O erro conceitual surge quando o algoritmo deixa de ser uma ferramenta auxiliar e passa a ser tratado como árbitro final do diagnóstico. Nenhum algoritmo muda o dado epidemiológico mais importante desse tema: a maioria das taquicardias de QRS largo é taquicardia ventricular, especialmente na presença de cardiopatia estrutural.
Por isso, as diretrizes são claras e pragmáticas: toda taquicardia de QRS largo deve ser tratada como TV até que se prove o contrário, sobretudo no cenário agudo. Curiosamente, os próprios algoritmos quase não aparecem nos fluxos de manejo imediato das diretrizes — um sinal claro de suas limitações clínicas.
Em resumo, os algoritmos organizam o raciocínio, ajudam no ensino e são úteis na análise pós-aguda. Mas confiar cegamente em sua acurácia é mais um mito do ECG.
No mundo real, o diagnóstico das taquicardias de QRS largo continua sendo probabilístico, contextual e clínico. O ECG ajuda — mas não decide sozinho.
O Aumento da Amplitude do QRS
Talvez nenhum critério do ECG esteja tão profundamente associado à ideia de sobrecarga ventricular quanto o aumento da voltagem do QRS. Desde os primeiros critérios de Sokolow‑Lyon até o Cornell, a lógica ensinada é simples: ventrículo maior gera QRS maior. O problema é que essa relação, embora intuitiva, é incompleta — e muitas vezes enganosa.
O paradigma clássico parte do pressuposto de que o aumento da massa ventricular esquerda gera um campo elétrico maior, que obrigatoriamente se traduz em maiores amplitudes do QRS. No entanto, como bem discutido por Bacharova e colaboradores, o ECG não registra massa, mas sim fenômenos elétricos. E esses fenômenos dependem muito mais das propriedades eletrofisiológicas do miocárdio do que do seu tamanho isolado.
Do ponto de vista biofísico, a voltagem registrada no ECG é explicada pelo teorema do ângulo sólido, que mostra que o sinal depende não apenas da extensão da frente de ativação (relacionada à massa), mas também da velocidade de condução, da condutividade intra e extracelular e da proporção entre tecido eletricamente ativo e inativo. Em outras palavras: massa é só uma parte da história.
Na hipertrofia ventricular esquerda real, o miocárdio sofre profundas alterações estruturais: hipertrofia e ramificação dos cardiomiócitos, remodelamento das junções gap (especialmente da conexina‑43), fibrose intersticial, inflamação e, frequentemente, isquemia associada. Essas mudanças alteram tanto a ativação elétrica quanto a propagação do estímulo — e podem aumentar, manter normal ou até reduzir a voltagem do QRS, independentemente da massa ventricular.
Isso ajuda a explicar um achado clássico e pouco valorizado: a baixa sensibilidade dos critérios de voltagem. Mesmo no estudo original de Sokolow‑Lyon, apenas cerca de 30% dos pacientes com hipertrofia anatômica apresentavam aumento significativo da voltagem. Os chamados “falsos negativos” não são um erro do ECG — são, na verdade, um reflexo de miocárdio eletricamente doente, muitas vezes com fibrose difusa.
Curiosamente, estudos com ressonância magnética mostram que quanto maior a fibrose miocárdica, menor tende a ser a voltagem do QRS, mesmo em ventrículos francamente hipertrofiados. Em alguns cenários, a ausência de critérios eletrocardiográficos de hipertrofia está associada a pior prognóstico, como observado em pacientes com estenose aórtica submetidos a TAVI.
O inverso também é verdadeiro: QRS de alta voltagem não garante hipertrofia verdadeira. Alterações regionais da condução, fibrose localizada, isquemia transitória e até situações agudas podem gerar aumento da voltagem e simular critérios clássicos de sobrecarga, mesmo sem aumento real da massa ventricular.
Por isso, cresce o conceito de que o ECG não deve ser usado para “medir hipertrofia”, mas para avaliar remodelamento eletrofisiológico. Propostas mais modernas sugerem analisar a relação entre voltagem do QRS e massa ventricular (ou área ventricular), entendendo quanto de miocárdio é necessário para gerar determinada voltagem — uma abordagem muito mais fisiopatológica do que simplesmente contar milímetros.
Resumo do mito: QRS alto não é sinônimo de ventrículo grande, e QRS normal não exclui sobrecarga importante. A voltagem do QRS fala menos de tamanho e muito mais de qualidade elétrica do miocárdio. No ECG, como quase sempre, o problema não está no traçado — está na interpretação simplista dele.
Receba ECG de verdade no seu e-mail
Se você gosta desse tipo de conteúdo — direto, crítico e baseado em fisiopatologia — vale se inscrever na newsletter do Aprenda ECG.
Na newsletter eu compartilho leituras guiadas de ECG, discussões de casos reais, conceitos que não cabem em posts curtos e reflexões clínicas que ajudam a pensar melhor o eletrocardiograma no dia a dia, sem mitos e sem automatismos.
É gratuita, prática e feita para quem realmente usa ECG na clínica.
👉 Inscreva-se na newsletter do Aprenda ECG
Quer ir além dos mitos? Conheça o Mestre do ECG
Se você chegou até aqui, já percebeu que ler ECG não é decorar critérios, nem repetir frases prontas. É entender fisiopatologia, vetores, condução, contexto clínico — e, principalmente, aprender a pensar com o traçado, não apesar dele.
Foi exatamente para isso que eu criei o Mestre do ECG.
O curso é um treinamento completo e progressivo em eletrocardiografia clínica, focado em:
- construir raciocínio sólido, e não leitura automática;
- entender por que o ECG se comporta como se comporta;
- evitar os erros conceituais clássicos que discutimos neste artigo;
- ganhar segurança real para interpretar ECGs do dia a dia e dos cenários críticos.
Se você quer sair do nível de “reconhecer padrões” e chegar ao nível de compreender o ECG de verdade, o Mestre do ECG é o próximo passo natural.
👉 Conheça o curso Mestre do ECG

Conclusão
Os mitos do ECG não persistem por acaso. Eles sobrevivem porque oferecem respostas rápidas, simples e confortáveis para um exame que, na realidade, é complexo, contextual e probabilístico. O problema é que, no ECG, atalhos cognitivos quase sempre cobram um preço clínico.
Ao longo deste artigo, vimos exemplos clássicos desse erro: o supra feliz que não exclui infarto, a progressão lenta da onda R que não define cicatriz anterior, a onda T negativa que não indica isquemia aguda, a onda P longa que fala de condução — e não de tamanho —, o S1Q3T3 que não diagnostica TEP, a inexistência da parede dorsal, a falsa precisão dos algoritmos de QRS largo e a armadilha de interpretar voltagem como massa.
O fio condutor é sempre o mesmo: interpretar achados isolados fora do contexto clínico e fisiopatológico. O ECG não foi feito para fornecer rótulos automáticos, mas para integrar informação elétrica, anatômica e clínica em um raciocínio coerente.
Talvez a principal mensagem seja esta: o ECG erra menos do que se pensa. Quem erra mais somos nós, quando tentamos simplificá-lo demais. Ler bem um eletrocardiograma exige abandonar mitos, aceitar incertezas e, acima de tudo, entender o porquê dos traçados — não apenas decorá-los.
Referências
- Scheffer MK, de Alencar Neto JN, De Marchi MFN, Felicioni SP. Eletrocardiograma na síndrome coronária aguda. São Paulo: Manole, 2025.
- Smith SW. Upwardly concave ST segment morphology is common in acute left anterior descending coronary occlusion. J Emerg Med. 2006;31(1):69–77.
- Bayés De Luna A, Platonov P, Cosio FG, Cygankiewicz I, Pastore C, Baranowski R, et al. Interatrial blocks. A separate entity from left atrial enlargement: A consensus report. J Electrocardiol [Internet]. 2012;45(5):445–51.
- McGinn S, White PD. Acute cor pulmonale resulting from pulmonary embolism. J Am Med Assoc. 1935;104(17):1473
Smaniotto MF, Alencar E Silva GPS, Heringer J de N, Almeida MT de C, Scheffer MK, Felicioni SP, et al. Classical ECG findings in pulmonary embolism have minimal diagnostic accuracy: A cross-sectional study. J Investig Med Off Publ Am Fed Clin Res. 30 de junho de 2025;10815589251357621. - Brugada P, Brugada J, Mont L, Smeets J, Andries EW. A new approach to the differential diagnosis of a regular tachycardia with a wide QRS complex. Circulation. 1991 May;83(5):1649–59.
1. - Bayes de Luna A, Zareba W, Fiol M, Nikus K, Birnbaum Y, Baranowski R, et al. Negative T wave in ischemic heart disease: A consensus article. Annals of Noninvasive Electrocardiology 2014;19(5):426–41.
- Bayés de Luna A, Wagner G, Birnbaum Y, Nikus K, Fiol M, Gorgels A, et al. A New Terminology for Left Ventricular Walls and Location of Myocardial Infarcts That Present Q Wave Based on the Standard of Cardiac Magnetic Resonance Imaging. Circulation. 2006;114(16):1755–60.
- de Alencar JN, Amorim EF, Scheffer MK, Felicioni SP, De Marchi MFN. Poor evidence for poor R wave progression in coronary disease: A scoping review. J Electrocardiol. 2024;84(500):145–50.
- Jastrzebski M, Kukla P, Czarnecka D, Kawecka-Jaszcz K. Comparison of five electrocardiographic methods for differentiation of wide QRS-complex tachycardias. EP Europace 2012;14(8):1165–71. Available from:
- Bacharova L. ECG in left ventricular hypertrophy: A change in paradigm from assessing left ventricular mass to its electrophysiological properties. J Electrocardiol 2022;73(May):153–6. Available from:




